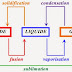
Tout ce qui est matière dans le monde peut exister que dans trois états:
GAZEUX - LIQUIDE - SOLIDE
Certaines substances peuvent adopter les trois états à différentes températures.
1) Loi de la fusion et de la solidification:
Sous une même pression la température de fusion et la température de solidification sont identiques.
Toujours sous une même pression, cette température reste constante durant toute la durée du changement d'état, (on constatera par contre une variation de volume).
2) La vaporisation:
Elle peut s'effectuer sous deux formes:
- Par ébullition, c'est à dire vaporisation d'un liquide avec formation de bulle au sein de ce liquide.
- Par évaporation, c'est à dire avec formation de vapeur à la surface de ce liquide.
Cette évaporation est d'autant plus rapide que:
- la température est élevée,
- la surface libre du liquide est grande,
- l'atmosphere est sèche et renouvelée,
- la tension de vapeur saturante du liquide est élevée.
2-1) Lois de l'ébullition:
Sous une même pression, un liquide commence à bouillir à la même température.
Pendant toute la durée de l'ébullition, la température reste constante si la pression reste constante.
2-2) point normal d'ébullition:
C'est la température d'ébullition sous la pression atmosphérique.
Si on veut diminuer la température d'ébullition, il faut diminuer la pression supportée par le liquide.
Si on veut augmenter la température d'ébullition, il faut augmenter la pression supportée par le liquide.
Exemple de température d'ébullition de l'eau sous différente pression:
151°C à 5 bars
100°C à 1 bars
68°C à 0,3 bars
12,7°C à 0,015 bars
6,7°C à 0,010 bars
Au niveau de la mer l'eau bout donc à 100°C, par contre en montagne à 3000 m elle boue à 89,4°C.
3) La condensation:
On obtient la condensation d'une vapeur par deux moyens:
-Par compression
-Par refroidissement
La plupart des gaz peuvent être liquéfiés sous l'action d'une pression croissante. Mais on obtient à une certaine pression un équilibre dynamique entre le liquide et sa vapeur. Chaque molécule de vapeur qui se condense implique la vaporisation d'une molécule de liquide.
A cette pression de saturation correspond une température appelée température critique.
4) La sublimation:
C'est le passage direct de l'état solide à l'état gazeux.
Cette propriété n'appartient qu'à certain corps.
Ce phénomène se produit à pression constante à une température bien déterminée.
Exemple: la neige carbonique, la naphtaline.
5) Les différentes chaleurs et leurs significations:
5-1) La chaleur massique
C'est la quantité de chaleur qu'il faut donner ou retirer à un corps de 1kg pour varier sa température de 1°C sans en modifier son état.
Cette chaleur est différente selon l’état considéré.
Exemple: l'eau
c(pour la glace) = 2,09 kJ/kg°C
c (pour l'eau) = 4,18 kJ/kg°C
c (pour la vapeur) = 1,88 kJ/kg°C
d’autres exemples:
c (pour le plomb) = 0,12 kJ/kg°C
c (pour le cuivre) = 0,39 kJ/kg°C
c (pour l’alcool) = 2,46 kJ/kg°C
5-2) La chaleur sensible
C'est la quantité de chaleur qui provoque une variation de la température d'un corps considéré, sans pour autant modifier l'état physique de ce corps.
Q = m c ∆t
Q = Chaleur totale (kJ)
m = masse (kg)
∆t = température finale - température de départ (°C)
c = chaleur massique du corps en son état (kJ/kg°C)
5-3) La chaleur latente
C'est la quantité de chaleur qu'il faut fournir à un corps pour le faire passer d'un état physique donné à un autre état physique sans modifier sa température, ceci à pression constante.
Q = m L
On a LF (chaleur latente de fusion) et LV (chaleur latente de vaporisation).
LF et LV s'expriment en kJ/kg.
Exemple:
l'eau LF = 335 kJ/kg 0°C à la P.atm.
LV = 2245 kJ/kg 100°C à la P.atm.
D’autres exemples:
LV (pour l’alcool) = 904 kJ/kg 78°C à la P.atm.
LF (pour le plomb) = 23 kJ/kg 327°C à la P.atm.
LV (pour le R22) = 234 kJ/kg -40°C à la P.atm.
LF (pour l’aluminium) = 335 kJ/kg 658°C à la P.atm.
LV (pour l’éther) = 376,5 kJ/kg 35°C à la P.atm.
LF (pour le cuivre) = 180 kJ/ kg 1083°C à la P.atm.
6) Exemple de calcul:
Nous avons 15 kg de glace à -10°C, nous voulons les porter à une température de 120°C.
Quelle quantité de chaleur faut-il pour avoir de la vapeur à 120°C?
Q1 = m c ∆t = 15 x 2,09 x (0- (-10)) = 313,5 kJ
Q2 = m LF = 15 x 335 = 5025 kJ
Q3 = m c∆t = 15 x 4,18 x (100- 0) = 6270 kJ
Q4 = m LV = 15 x 2245 = 33675 kJ
Q5 = m c ∆t = 15x. 1,88 x (120- 100) = 564 kJ
QT = Q1+Q2+Q3+Q4+Q5 = 45847,5 kJ













0 commentaires: